Hydrogen ion concentration

source : youtube.com
Hydrogen ion concentration-
Sorenson gave a new term pH to express hydrogen ion concentration. “pH is the negative logarithm of H+ ( hydrogen ion) concentration.”
pH=–log[H+] or pH = 1/log[H+]
[H+]=10–pH
pOH= – log [OH–]
pOH= 1/ log [OH–]
Kw= [H+][OH–] = 1×10–14
Kw= ionic product of water= 1×10–14
pKw = pH+ pOH
pH+pOH =14
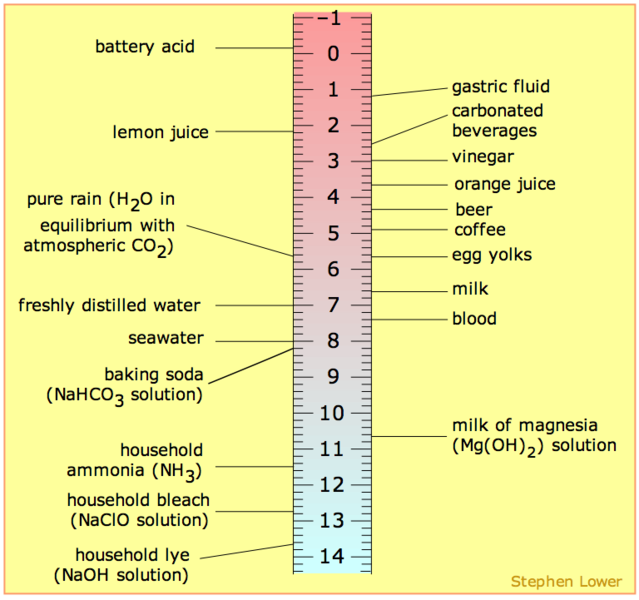
pH Scale-
If (H+)= 10–7, pH=7 then Solution is neutral
If (H+) > 10–7, pH<7 then solution is acidic
If (H+) < 10–7, pH>7 then solution is alkaline
pH and nature of solution-
[H+] [OH–] pH pOH Nature of solution
100 10-14 0 14 Strongly acidic
10-2 10-12 2 12 Acidic
10-5 10-9 5 9 Weakly acidi
10-7 10-7 7 7 Neutral
10-9 10-5 9 5 Weakly basic
10-11 10-3 11 3 Basic
10-14 10-0 14 0 Strongly basic

source : Scroll.in
pH range of some substances-
1.0 – 3.0 Gastric contents
2.0 – 4.0 Soft drinks
2.2 – 2.4 Lemon
2.4 – 3.4 Vinegar
2.9 – 3.3 . Apple
4.8 – 8.4 . Human urine
6.3 – 6.6 . Cow milk
6.5 – 7.5 Human Saliva
7.3 – 7.5 Human blood plasma
8.5 Sea water
10.5 Milk of magnesia